 COMUNICATO CONGIUNTO INFN-TELETHON-UNITN. Lo studio dell’Istituto Telethon Dulbecco e dell’Università di Trento, in collaborazione con l’Istituto Nazionale di Fisica Nucleare e altri due centri accademici in Spagna e Canada, permetterà di andare alla ricerca mirata di farmaci in grado di contrastare gravi malattie neurodegenerative ad oggi incurabili.
COMUNICATO CONGIUNTO INFN-TELETHON-UNITN. Lo studio dell’Istituto Telethon Dulbecco e dell’Università di Trento, in collaborazione con l’Istituto Nazionale di Fisica Nucleare e altri due centri accademici in Spagna e Canada, permetterà di andare alla ricerca mirata di farmaci in grado di contrastare gravi malattie neurodegenerative ad oggi incurabili.
Per la prima volta è stato realizzato un modello computazionale realistico che spiega il meccanismo di replicazione del prione, una proteina tossica che a metà degli anni Novanta è diventata famosa in tutto il mondo in quanto responsabile del “morbo della mucca pazza”: a descriverlo sulle pagine di PLOS Pathogens* è stato il gruppo di ricerca dell’Istituto Telethon Dulbecco presso l’Università di Trento guidato da Emiliano Biasini, in collaborazione con il gruppo di Pietro Faccioli del dipartimento di Fisica dello stesso ateneo e afferente all’Istituto Nazionale di Fisica Nucleare.
I prioni sono versioni anomale di proteine normalmente presenti nel cervello dei mammiferi (ma presenti anche in altre specie come per esempio gli uccelli) in grado di replicarsi e propagarsi in maniera simile a virus e batteri. L’esatto meccanismo è ancora sconosciuto, ma si sa che possono indurre il cambiamento della loro forma normale in quella anomala: nel tempo quest’ultima prende il sopravvento e forma degli aggregati che uccidono le cellule nervose, provocando delle gravissime patologie neurodegenerative chiamate encefalopatie spongiformi trasmissibili. Quelle che colpiscono l’uomo note finora sono la malattia di Creutzfeldt-Jakob, l’insonnia fatale familiare e la malattia di Gerstmann-Sträussler-Scheinker: si tratta di malattie spontanee, genetiche o infettive molto rare, che insorgono in genere in età adulta dopo una latenza molto lunga, ma con un’evoluzione rapida e infausta dopo la comparsa dei primi sintomi. Molto nota è anche l’encefalopatia spongiforme bovina, che ha provocato una vera e propria epidemia a partire dalla metà degli anni Ottanta nei bovini prima in Inghilterra e poi in tutta Europa e ha fatto registrare anche alcuni rari casi di trasmissione all’uomo conseguente all’ingestione di carne infetta.
«Pur essendo noti fin dagli anni Ottanta grazie al lavoro del Premio Nobel Stanley Prusiner, i prioni sono agenti tuttora molto “sfuggenti” per chi li studia, perché non si possono osservare direttamente – spiega Emiliano Biasini, scienziato Telethon e professore associato al Dipartimento CIBIO dell’Università di Trento. «La loro tendenza ad aggregare, infatti, ha reso finora impossibile applicare la cristallografia a raggi X o la risonanza magnetica nucleare, i metodi più comunemente utilizzati per caratterizzare finemente la struttura delle proteine, fino al livello atomico; d’altra parte, un modello affidabile della proteina prionica è essenziale per disegnare delle strategie terapeutiche mirate. In questo senso, un grosso aiuto è arrivato da una disciplina apparentemente distante dalla biologia e dalla chimica, ovvero la fisica subatomica».
I ricercatori Telethon hanno rivisitato la struttura dei prioni e proposto un nuovo modello di conformazione in linea con i più aggiornati dati sperimentali. Grazie poi alla stretta collaborazione con il gruppo di Pietro Faccioli, hanno sfruttato un innovativo metodo di calcolo computazionale derivato da metodi matematici sviluppati in fisica delle particelle, per ricostruirne il meccanismo di replicazione. «L’interdisciplinarietà è stata la chiave vincente – spiega Giovanni Spagnolli, studente di dottorato al Dipartimento CIBIO dell’Università di Trento e primo autore del lavoro. Senza l’apporto dei colleghi fisici non saremmo stati in grado di eseguire calcoli così complessi con tempi e costi accessibili, mentre grazie a loro abbiamo trovato il modo di farlo con un grado di approssimazione affidabile ma al contempo sostenibile. Per la prima volta siamo riusciti a ricostruire il modo con cui i prioni riescono a replicarsi e contiamo di sfruttare queste informazioni per cercare o addirittura costruire razionalmente molecole in grado di bloccare la replicazione dei prioni e arrestare il processo neurodegenerativo ad oggi incurabile».
«Il metodo di calcolo che ha portato a questo risultato si fonda su metodi matematici di fisica teorica che sono stati originariamente sviluppati per studiare fenomeni tipici del mondo subatomico, come l’effetto tunnel quantistico. Questi metodi matematici sono stati da noi adattati per consentire la simulazione di processi biomolecolari complessi, come il ripiegamento e l’aggregazione di proteine - sottolinea Pietro Faccioli, professore associato nel Dipartimento di Fisica dell’Università di Trento e affiliato all’ Istituto Nazionale di Fisica Nucleare.
Questo studio è stato finanziato da Fondazione Telethon e ha visto la collaborazione anche dell’Università di Santiago de Compostela (Spagna) e dell’Università di Alberta (Canada).
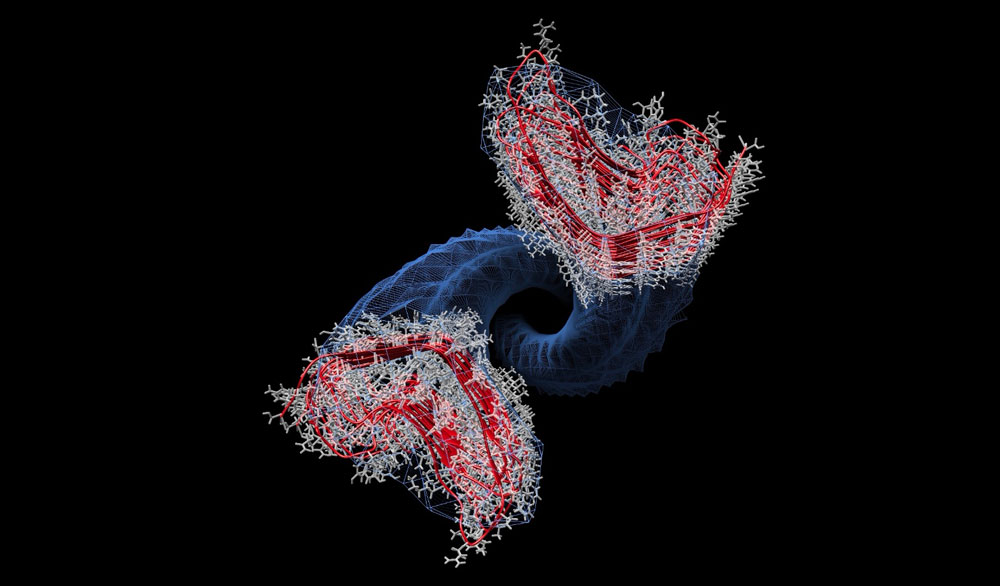
Link al video che mostra il meccanismo con cui la proteina prionica nella sua forma aggregata e infettiva (in rosso) induce la sua controparte sana (in blu) a cambiare forma. Si noti che, una volta che la proteina si è trasformata nella forma aggregata è a sua volta in grado di indurre il cambio di conformazione di altre proteine sane adiacenti. Gli aggregati di proteina “rossa”, una volta raggiunta una certa dimensione, si spezzano: ciascun frammento è a sua volta in grado di reclutare altre proteine sane adiacenti, con un effetto a cascata che con il passare del tempo porta a un vasto accumulo di queste forme aberranti nel cervello dei pazienti.




