 Comunicato congiunto Sibylla Biotech-INFN: Trovate nuove tasche di legame della proteina ACE2 per successivi studi farmacologici, e se-lezionate al computer 35 molecole promettenti fra le 9000 analizzate, tra cui anche una molecola della famiglia chimica dell’idrossiclorochina. Il prossimo passo è andare in laboratorio.
Comunicato congiunto Sibylla Biotech-INFN: Trovate nuove tasche di legame della proteina ACE2 per successivi studi farmacologici, e se-lezionate al computer 35 molecole promettenti fra le 9000 analizzate, tra cui anche una molecola della famiglia chimica dell’idrossiclorochina. Il prossimo passo è andare in laboratorio.
Un nuovo bersaglio, anzi due, finora sconosciuti nella lotta farmacologica contro il COVID-19, per impedire al coronavirus di diffondersi nel corpo umano, riducendo al minimo effetti collaterali e l’evoluzione di resistenze, grazie a una strategia interamente nuova per il design di farmaci contro il coronavirus. Questo è l’orizzonte aperto nella ricerca biomedica grazie ai risultati ottenuti da Sibylla Biotech in collaborazione con l’Istituto Nazionale di Fisica Nucleare (INFN) e pubblicati oggi, 29 aprile, sull’archivio di preprint accademici ArXiv (https://arxiv.org/abs/2004.13493). Sibylla Biotech è una spin-off dell’INFN e delle Università di Trento e Perugia.
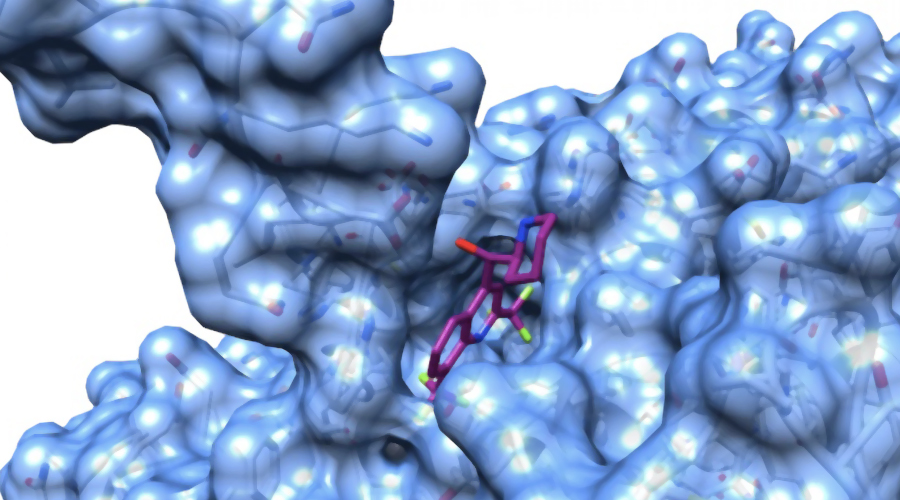
Sibylla Biotech è, infatti, riuscita a individuare due bersagli per il design di farmaci, ovvero due “tasche” nelle strutture intermedie di ACE2, una proteina che si trova normalmente sulla superficie delle cellule polmonari (oltre che delle cellule di altri organi come cuore e intestino) e che il virus SARS-CoV-2 usa come ‘porta d’ingresso’ per l’infezione. Questi due stati intermedi della proteina, che possono diventare due ‘talloni d’Achille’ per il coronavirus, sono già stati analizzati al calcolatore da Sibylla per verificare la loro capacità di legare con i circa 9000 farmaci già commercialmente disponibili oppure in fase di sperimentazione clinica.
In questa fase preliminare, che dovrà necessariamente essere seguita da test in laboratorio per poter dare risposte definitive, Sibylla Biotech ha già identificato 35 molecole promettenti. Tra cui anche una molecola della famiglia chimica cui appartiene l’idrossiclorochina, che pure risulta legare l’intermedio di ACE2 e verrà valutata in laboratorio insieme ad altre 6 molecole analoghe della stessa famiglia e alle 35 selezionate al computer.
L’idrossiclorochina sembra limitare la replicazione del virus in vitro ma le sue potenzialità contro il COVID-19 sono molto discusse e controverse. Non è affatto chiaro al momento se l’idrossiclorochina o i suoi analoghi possano o meno essere efficaci contro il COVID-19, ed è bene sottolineare come anche le più avanzate predizioni informatiche siano solo utili punti di partenza per le conferme sperimentali e cliniche. Nell’ipotesi ancora da dimostrare di una qualche efficacia clinica, però, l’analisi di Sibylla potrebbe contribuire a spiegarne il meccanismo d’azione molecolare e contribuire alla messa a punto di protocolli clinici mirati.
Su richiesta, Sibylla mette liberamente a disposizione la ricostruzione a livello atomico delle tasche di legame di ACE2, affinché chi possiede molecole proprietarie possa eseguire dei test al computer e quindi in laboratorio su questi bersagli. Questo di Sibylla è quindi un risultato che può dare un contributo importante nel campo degli antivirali, ma anche una prospettiva per la terapia di altre malattie.
Come ha dichiarato la CEO Lidia Pieri “In questo momento storico chiunque abbia un’idea e i mezzi per poterla sviluppare, anche se solo in parte, deve scendere in campo. Non c’è scelta e la straordinaria risposta di INFN, che ci ha messo a disposizione le ingenti risorse di calcolo necessarie a Sibylla per questo studio, dimostra che sono possibili grandi cose. I risultati oggi non sono ancora definitivi, ma avremo presto una risposta dal laboratorio con cui confrontarci. Le informazioni che otteniamo sono liberamente al servizio della comunità. Chiunque può utilizzarle per cercare una cura. Noi intanto continuiamo a portare avanti la ricerca fin dove possiamo spingerci con i nostri mezzi”.
"Siamo molto soddisfatti per questo risultato, seppur preliminare, perché prova l'efficacia della originale strategia elaborata e messa in atto da Sibylla. Ma anche perché testimonia le promettenti prospettive che la ricerca fondamentale in fisica può aprire in altri campi, con lo sviluppo di applicazioni spesso all'inizio inaspettate. E, infine ma non ultimo, perché evidenzia il valore e l'efficacia dell'approccio multidisciplinare nella ricerca, ancor più quando si deve far fronte comune nelle grandi sfide scientifiche, come quella che oggi ci vede tutti coinvolti, contribuendo ognuno con le proprie competenze per contrastare la pandemia” sottolinea Antonio Zoccoli, presidente dell’INFN.
Come è stato ottenuto il risultato
Per la prima volta al mondo, grazie alla metodologia PPI-FIT (Pharmacological Protein Inactivation by Folding Intermediate Targeting) sviluppata da Pietro Faccioli, professore associato del dipartimento di Fisica dell’Università di Trento e affiliato all’Istituto Nazionale di Fisica Nucleare, e Emiliano Biasini, professore associato al Dipartimento CIBIO dell’Università di Trento e scienziato Telethon, co-fondatori di Sibylla Biotech che la detiene in licenza esclusiva, la ricerca farmacologica può agire sistematicamente su un processo biochimico universale: il folding o ripiegamento delle proteine. È il processo con cui le proteine, come ACE2, acquisiscono la loro struttura all’interno delle cellule.
Agendo sul folding, un farmaco può bloccare la maturazione della proteina ACE2 sul nascere, togliendo punti di ingresso al virus e bloccando l’infezione. Una strategia che oggi è possibile mettere in campo in tempi rapidi solo grazie alla tecnologia di Sibylla, e che potrebbe portare a comprendere come ridurre la quantità di ACE2 senza eliminarla necessariamente del tutto, mantenendo quindi la funzione naturale della proteina e riducendo il rischio di effetti collaterali. A differenza di un farmaco che colpisce le proteine virali, inoltre, ridurre l’espressione di ACE2 renderebbe difficile l’evolversi di resistenze. Per agire sul folding di una proteina come ACE2 servono simulazioni a livello dei singoli atomi. Un calcolo che, anche con i più avanzati supercomputer, richiederebbe centinaia o migliaia di anni.
Qui interviene un’altra tecnologia in licenza esclusiva sviluppata dai co-fondatori di Sibylla Biotech, il Bias Functional Approach (BFA). Grazie a metodi matematici originariamente pensati per la fisica quantistica, la tecnologia BFA accelera questi calcoli oltre 10.000 volte, analizzando il folding in poche settimane e trovando le strutture della proteina su cui un farmaco può agire. Così Sibylla in sole tre settimane è riuscita a simulare, per la prima volta al mondo, il folding di ACE2. A questo ha contribuito la generosa disponibilità delle risorse dell’INFN, che ha allocato a Sibylla Biotech ben 30.000 unità di calcolo, finora impegnate nell’analisi degli esperimenti di fisica subnucleare di LHC. ACE2 è porta d’ingresso anche del coronavirus SARS-CoV-1, che causò l’epidemia di SARS del 2002-2003 e di altri coronavirus. La stessa strategia sviluppata da Sibylla Biotech potrebbe essere, quindi, efficace anche contro di loro. E, più in generale, si può applicare anche ad altre proteine che fungono da porta d’ingresso per altri virus o patogeni.
Lo studio oggi pubblicato da Sibylla è quindi non solo un primo passo fondamentale verso una possibile terapia antivirale contro il COVID-19, ma anche l’esordio di un nuovo, brillante approccio alla ricerca di farmaci contro le infezioni virali e altre malattie.
APPROFONDIMENTI
Come entra il virus: perché ACE2
I virus, come il SARS-CoV-2 responsabile dell’attuale pandemia, per riprodursi devono legarsi a proteine naturalmente esposte sulla superficie delle cellule che infettano. In particolare SARS-CoV-2 lega la propria proteina Spike alla proteina umana ACE2. L’aggancio tra la proteina Spike e ACE2 è l’atto di ingresso del virus, quindi uno dei processi più importanti dove una terapia può agire. Se ostacoliamo questa interazione, il virus non può entrare nelle cellule dell’organismo e non può danneggiare i polmoni né diffondersi ad altre cellule. Perché non concentrarsi sulla proteina virale, Spike? Le proteine virali tendono a mutare rapidamente e sviluppano quindi resistenza al farmaco. Sono quindi bersagli sfuggenti, e un farmaco disegnato per essa rischia di non essere più utile dopo qualche tempo. È più efficace interferire con la proteina umana ACE2, che è più stabile, togliendo al virus le ‘serrature’ da cui poter aprire le porte del nostro organismo. Esistono già farmaci che contrastano la funzione enzimatica naturale di ACE2, ma sappiamo che questi farmaci non ostacolano l’infezione del virus. È necessario quindi il design di nuove molecole. ACE2 nell’organismo umano sano è una proteina importante per la regolazione della pressione sanguigna. Annullare completamente l’espressione di ACE2 potrebbe quindi portare a effetti collaterali. La funzione di ACE2 è anche protettiva rispetto ai danni polmonari causati dal virus. È quindi desiderabile sì ridurre l’espressione di ACE2, rallentando l’ingresso del virus e permettendo al sistema immunitario di combatterlo, ma non annullarla del tutto.
Come già dimostrato in precedenza da Sibylla Biotech nel caso della proteina prionica, la tecnologia PPI-FIT permette il design di potenziali farmaci che modulano in modo continuo la quantità di proteina, permettendo al terapeuta di ridurne l’espressione fino al livello desiderato: un controllo fine che permette di mantenere il giusto equilibrio tra riduzione dell’infezione e funzionalitàà del paziente.
Chi è Sibylla Biotech
Sibylla Biotech nasce nel 2017 come spin-off dell’INFN Istituto Nazionale di Fisica Nucleare, delle Università di Trento e Perugia. Il focus di Sibylla Biotech è lo sviluppo e l’applicazione delle tecnologie BFA e PPI-FIT per lo studio della dinamica delle biomolecole e l’identificazione di target farmacologici. Due tecnologie che insieme permettono a Sibylla, in esclusiva mondiale, il design di farmaci capaci di interferire col folding delle proteine, aprendo una strategia interamente nuova allo sviluppo di terapie. Sibylla ne ha ottenuto la licenza in esclusiva mondiale INFN, Università di Trento e Fondazione Telethon che hanno originariamente finanziato la ricerca. Una eccellenza tecnologica che è stata premiata nell’estate 2019 dal fondo Vertis Venture 3 Tech Transfer, che ha deciso di investire in Sibylla Biotech una cifra oltre il milione di euro. Grazie al finanziamento, Sibylla ha potuto costruire il proprio data center, in grado di svolgere le simulazioni molecolari e il virtual screening, e approntare il proprio laboratorio biomolecolare ospitato all’interno del dipartimento CIBIO dell’Università di Trento.
Oggi il team di Sibylla Biotech, guidato dalla CEO Lidia Pieri, include competenze che vanno dalla fisica sub-nucleare, all’informatica, alla biologia cellulare, alla chimica farmaceutica, in un team dove l’interdisciplinarità è la chiave vincente.
Sito web - https://www.sibyllabiotech.it/
Il folding e la tecnologia PPI-FIT
La tecnologia PPI-FIT (Pharmacological Protein Inactivation by Folding Intermediate Targeting) è un cambiamento di paradigma nel design razionale di farmaci. Progettare un farmaco significa creare una piccola molecola che sia capace di legare una molecola biologica -come una proteina- in modo da modularne o bloccarne l’attività. Finora il design di farmaci si concentrava sulla cosiddetta struttura tridimensionale nativa della proteina. Sibylla Biotech ha aperto le porte a una strategia completamente diversa di progettazione di potenziali farmaci, grazie a una tecnologia rivoluzionaria che combina avanzati concetti di fisica alla concreta applicazione biologica. Ogni proteina nasce come una catena di amminoacidi legati l’uno al successivo come le perle di una collana. Quando viene sintetizzata nella cellula, la “collana” di amminoacidi si ripiega su sé stessa, fino a diventare una sorta di “gomitolo” che è la struttura nativa. Questo ripiegamento viene denominato, in inglese, folding. Se qualcosa interferisce con il folding e la proteina non riesce ad acquistare la propria struttura finale, la cellula interviene e distrugge prontamente la proteina ‘malformata’. Un farmaco capace di interrompere il processo di folding può quindi ridurre o eliminare la quantità di proteina funzionante presente. In particolare, durante il folding la proteina può assumere delle configurazioni dette intermedi, che sebbene temporanee possono esistere abbastanza a lungo perché una piccola molecola vi si possa agganciare, bloccando l’ulteriore ripiegamento. Questo è il concetto biochimico alla base della metodologia PPI-FIT.
Il problema è conoscere la struttura degli intermedi. Mentre la struttura nativa è relativamente statica, e può essere osservata con metodi sperimentali, il folding è un processo dinamico, in cui la proteina fluttua raggiungendo passo dopo passo la sua configurazione finale. L’unico modo per conoscere le strutture che la proteina assume durante il folding è quello di simulare il moto della proteina al calcolatore. Oggi, anche utilizzando il più grande supercomputer al mondo, appositamente progettato per questo genere di calcoli, ci vorrebbero secoli o millenni per ottenere le strutture degli intermedi. Qui interviene l’altro balzo tecnologico di Sibylla Biotech, frutto di una visione interdisciplinare nata all’interno del panorama scientifico dell’INFN, che collega la fisica teorica con la chimica e la biologia. Grazie a un metodo di calcolo del tutto innovativo, il Bias Functional Approach (BFA), concepito dal cofondatore di Sibylla, Pietro Faccioli, Sibylla Biotech può accelerare i calcoli di decine di migliaia di volte, ricavando nel giro di poche settimane un quadro a livello atomico del folding della proteina. È quindi possibile estrarre le strutture degli intermedi di folding promettenti e applicare a queste strutture le metodologie normalmente applicate per la struttura nativa, identificando le ‘tasche’ nelle quali una piccola molecola sintetica possa infilarsi e bloccare il folding.
Non è solo teoria: i risultati di questo approccio teorico hanno già dimostrato le loro potenzialità nei laboratori. In ambito accademico i co-fondatori e partner scientifici di Sibylla Biotech hanno già identificato e testato in laboratorio una molecola capace di ridurre l’espressione della proteina prionica, causa della malattia neurodegenerativa di Cretuzfeld-Jakob. Inoltre nei primi sei mesi di operatività Sibylla Biotech ha ottenuto e validato in laboratorio composti potenzialmente attivi su proteine-target di interesse oncologico. La visione di Sibylla Biotech promette dunque di aprire la strada a farmaci innovativi per le più diverse patologie.
Contatti per la stampa
Massimo Sandal Ufficio Stampa Sibylla - Questo indirizzo email è protetto dagli spambots. È necessario abilitare JavaScript per vederlo.
Eleonora Cossi Ufficio stampa INFN - Questo indirizzo email è protetto dagli spambots. È necessario abilitare JavaScript per vederlo.

